Pereaksi Pembatas (Hitungan Kimia)
 Sesuai namanya, pereaksi pembatas adalah zat (pereaksi)
yang membatasi jumlah produk yang dihasilkan pada suatu reaksi.
Dikatakan membatasi jumlah produk yang dihasilkan karena zat tersebut
telah habis terlebih dahulu selagi zat yang lain masih ada, padahal
keberadaannya sangat diperlukan untuk reaksi selanjutnya (menghasilkan
produk). Jadi, pereaksi pembatas adalah pereaksi
yang habis terlebih dahulu (pertama kali).
Sesuai namanya, pereaksi pembatas adalah zat (pereaksi)
yang membatasi jumlah produk yang dihasilkan pada suatu reaksi.
Dikatakan membatasi jumlah produk yang dihasilkan karena zat tersebut
telah habis terlebih dahulu selagi zat yang lain masih ada, padahal
keberadaannya sangat diperlukan untuk reaksi selanjutnya (menghasilkan
produk). Jadi, pereaksi pembatas adalah pereaksi
yang habis terlebih dahulu (pertama kali).
Pereaksi pembatas dapat ditentukan dengan cara membagi jumlah mol
setiap pereaksi masing-masing dengan koefisien reaksinya (= kuosien
reaksi, Q). Tentu saja dari reaksi yang sudah setara. Pereaksi dengan
kuosien reaksi terkecil merupakan pereaksi pembatas. Dengan demikian
kalau tersedia beberapa zat pereaksi dengan jumlahnya masing-masing,
kita dapat meramalkan zat pereaksi apa yang nantinya habis terlebih
dahulu atau zat apa yang tersisa.
Untuk perhitungan selanjutnya, jumlah (mol) pereaksi pembatas dipakai
sebagai pembanding/ standarnya. Baik jumlah produk ataupun zat lain
yang bereaksi.
Contoh
: Sebanyak 6,5 gram logam Zn (Ar Zn = 65) direaksikan dengan 1000 mL
larutan HCl 0,16 M. Tentukan jumlah zat yang tersisa dan volume gas H2
yang dihasilkan (STP). Reaksi yang terjadi :
Zn (s) + 2HCl (aq) –> ZnCl2 (aq) + H2
(g)
Jawab :
Mol Zn = 6,5/65 = 0,1 mol (koefisien reaksi = 1)
Q Zn = 0,1/1 = 0,1
Mol HCl = 1000 x 0,16 = 160 mmol = 0,16 mol (koefisien reaksi = 2)
Q HCl = 0,16/2 = 0,08
Ternyata Q HCl < Q Zn, sehingga HCl merupakan pereaksi pembatas
(pereaksi yang habis lebih dulu).
. Zn (s) + 2HCl (aq) —> ZnCl2
(aq) + H2 (g)
Mula2 0,1 0,16
- -
Reaksi -0,08 -0,16
+0,08 +0,08
______________________________________________________ +
Akhir 0,02 mol
0 0,08 mol 0,08 mol
Zat yang tersisa Zn = 0,02 mol
= (0,02 x 65) gram
= 1,30 gram
Gas H2 yang dihasilkan = 0,08 x 22,4 L
= 1,72 L
Membuat Rumus Lewis
Memuat/menuliskan rumus Lewis adalah gampang-gampang susah. Gampang
kalau udah tau caranya, tetapi terkadang susah kalau pas ketemu dengan
senyawa yang agak kompleks rumusnya. Asal tahu jumlah elektron dari
masing-masing unsur. Pada dasarnya adalah dengan kira-kira
(coba-coba). Untuk senyawa-senyawa sederhana
ini cukup mudah.
Untuk senyawa-senyawa yang agak kompleks, atau yang mengandung ikatan
rangkap, atau ikatan koordinat konjugasi atau bahkan ion terkadang
menjadi hal yang cukup membuat pusing. Berikut ada satu cara yang dapat
dipakai :
- Hitung jumlah semua elektron yang dimiliki semua atom dalam senyawa
- Tulis kerangka dasar senyawa yang kira-kira masuk akal (atom pusat biasanya yang kekurangan elektronnya paling banyak)
- Berikan masing-masing sepasang elektron untuk setiap ikatan
- Sisa elektron dibagikan kepada semua atom pinggir agar mencapai oktet
- Bila elektron masih tersisa maka diberikan kepada atom pusat
- Tarik satu atau lebih pasangan elektron untuk membuat ikatan rangkap, sehingga atom pusat juga mencapai oktet.
- Hitung jumlah semua elektron yang dimiliki semua atom dalam senyawa
- Tulis kerangka dasar senyawa yang kira-kira masuk akal (atom pusat biasanya yang kekurangan elektronnya paling banyak)
- Berikan masing-masing sepasang elektron untuk setiap ikatan
- Sisa elektron dibagikan kepada semua atom pinggir agar mencapai oktet
- Bila elektron masih tersisa maka diberikan kepada atom pusat
- Tarik satu atau lebih pasangan elektron untuk membuat ikatan rangkap, sehingga atom pusat juga mencapai oktet.
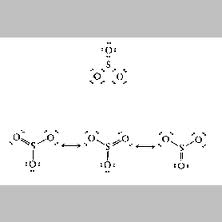
- Jumlah total elektron (6+3×6) = 24 elektron
- Kerangka dasar molekul : atom S di tengah dikelilingi 3 atom O
- Berikan 3 pasang (6 elektron) untuk 3 ikatan S-O ————————elektron tersisa 18
- Berikan masing-masing 3 pasang elektron kepada 3 atom O sehingga mencapai oktet —- tak ada elektron tersisa
- Atom S belum oktet, maka tarik sepasang elektron bebas dari O ke atom S membentuk ikatan rangkap
- Selesai, semua atom sudah oktet. Dua ikatan tunggal, satu ikatan rangkap.
- Kerangka dasar molekul : atom S di tengah dikelilingi 3 atom O
- Berikan 3 pasang (6 elektron) untuk 3 ikatan S-O ————————elektron tersisa 18
- Berikan masing-masing 3 pasang elektron kepada 3 atom O sehingga mencapai oktet —- tak ada elektron tersisa
- Atom S belum oktet, maka tarik sepasang elektron bebas dari O ke atom S membentuk ikatan rangkap
- Selesai, semua atom sudah oktet. Dua ikatan tunggal, satu ikatan rangkap.
Tatanama Senyawa (sekali lagi tentang tatanama)
Informasi terakhir yang penulis ketahui, ada lebih dari 10 juta
senyawa yang dikenal saat ini. Wow..! Apa aja tuh? Siapa yang mau
nyebutin? Ha ha ha.. Capek dech..! Untuk keperlun pendataan, tentulah
sekian senyawa yang jumlahnya aduhai itu harus dinamai semua satu demi
satu. Gak boleh ada yang terlewat. Siapa yang ngurusin semua itu?
Tenang aja, ada IUPAC, International Union of Pure and Applied
Chemistry. Perhimpunan ahli kimia murni dan
terapan Internasional.
Bagi kita-kita yang kebetulan harus berurusan dengan penamaan senyawa
kimia, “anak sekolahan, terutama kelas X”, saya punya sedikit tip yang
mungkin bisa berguna, disamping bisa langsung sowan ke sumbernya sono
(IUPAC) tentunya.
Dalam penamaan senyawa, sebaiknya dipahami bahwa penamaan senyawa
dikelompokkan atas senyawa kovalen biner, senyawa ion, senyawa basa,
senyawa garam dan senyawa asam. Masing-masing punya aturan
sendiri-sendiri. Mari kita cermati satu per satu. Senyawa kovalen
biner diberi nama dengan cara menggabungkan nama masing-masing unsur dan
diberi akhiran -ida (English : -ide). Jumlah atom masing-masing unsur
dicantumkan dengan prefiks/awalan mono, di, tri tetra dst. Awalan mono
pada nama unsur pertama tidak perlu dicantumkan. Contoh :
NO : nitrogen monoksida (nitrogen monoxide)
NO2 : nitrogen dioksida (nitrogen dioxide)
N2O : dinitrogen monoksida (dinitrogen monokside)
N2O3 : dinitrogen trioksida (dinitrogen trioxide)
N2O5 : dinitrogen pentoksida (dinitrogen pentoxide)
PCl5 : fosfor pentaklorida (phosphorus pentachloride)
NO2 : nitrogen dioksida (nitrogen dioxide)
N2O : dinitrogen monoksida (dinitrogen monokside)
N2O3 : dinitrogen trioksida (dinitrogen trioxide)
N2O5 : dinitrogen pentoksida (dinitrogen pentoxide)
PCl5 : fosfor pentaklorida (phosphorus pentachloride)
Kedua, senyawa ion. Senyawa jenis ini diberi nama dengan cara
menggabungkan nama ion kation dan nama anion penyusunnya, tanpa ada
prefiks/awalan mono, di, tri dan sebagainya. Contoh :
FeCl2 : besi(II) klorida atau iron(II) chloride bukan besi(II) diklorida
FeCl3 : besi(III) klorida atau iron(III) chloride
Cu(NO3) : tembaga(I) nitrat atau copper(I) nitrate
Cu2S : tembaga(I) sulfida
CuS : tembaga(II) sulfida
FeCl2 : besi(II) klorida atau iron(II) chloride bukan besi(II) diklorida
FeCl3 : besi(III) klorida atau iron(III) chloride
Cu(NO3) : tembaga(I) nitrat atau copper(I) nitrate
Cu2S : tembaga(I) sulfida
CuS : tembaga(II) sulfida
Ketiga, senyawa basa. Senyawa basa merupakan senyawa ion, tetapi
anionnya berupa ion hidroksida (OH-). Diberi nama dengan menyebutkan nama
kation diikuti kata “hidroksida” atau “hidroxide“.
Contoh :
NaOH : natrium hidroksida (hanya punya satu bilangan oksidasi, tidak disebutkan)
HgOH : raksa(I) hidroksida
Hg(OH)2 : raksa(II) hidroksida
NaOH : natrium hidroksida (hanya punya satu bilangan oksidasi, tidak disebutkan)
HgOH : raksa(I) hidroksida
Hg(OH)2 : raksa(II) hidroksida
Keempat, senyawa garam. Merupakan senyawa ion, dengan ion negatifnya
berupa selain OH-, O2-, N3-. Penamaan sama dengan senyawa ion yang
lain.
Kelima, senyawa asam. Senyawa asam merupakan senyawa kovalen polar.
Dalam air terurai menjadi ion H+ dan ion sisa asam (anion sisa asam).
Senyawa ini diberi nama dengan cara menggabungkan kata “asam” dirangkai
dengan nama ion sisa asamnya. Contoh :
HCl : asam klorida
HBr : asam bromida
HNO2 : asam nitrit
HNO3 : asam nitrat
HCl : asam klorida
HBr : asam bromida
HNO2 : asam nitrit
HNO3 : asam nitrat
Radioaktifitas
Radioaktifitas ternyata terjadi karena adanya ketidakstabilan inti.
Radioaktifitas sendiri merupakan peristiwa pemancaran radiasi partikel
atau energi secara spontan. Partikel yang dipancarkan oleh oleh zat
radioaktif dapat berupa partikel alfa, netron, beta, beta positif
ataupun gama . Jenis partikel apa yang dipancarkan oleh suatu inti
radioaktif dapat diperkirakan berdasarkan komposisi netron-proton (n/p)
dalam inti. Hal ini dapat dipahami dengan
baik dengan mencermati peta radioisotop berikut ini.
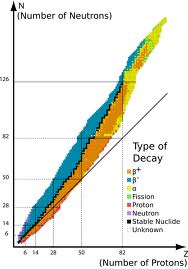 Daerah berwarna yang berbentuk pita tersebut berisi data n/p
dari inti-inti yang stabil, sehingga dinamai dengan pita kestabilan.
Inti-inti pada daerah tersebut memiliki harga n/p antara 1 (untuk
inti-inti ringan) sampai dengan 1,5 (untuk inti-inti besar).
Daerah berwarna yang berbentuk pita tersebut berisi data n/p
dari inti-inti yang stabil, sehingga dinamai dengan pita kestabilan.
Inti-inti pada daerah tersebut memiliki harga n/p antara 1 (untuk
inti-inti ringan) sampai dengan 1,5 (untuk inti-inti besar).
Daerah di atas pita kestabilan adalah daerah dengan harga n/p >
1. Inti-inti yang berada pada daerah ini bersifat tidak stabil karena
kelebihan jumlah netron. Inti-inti jenis ini akan berusaha mencapai
pita kestabilan dengan cara merubah kelebihan netron menjadi proton,
yaitu dengan memancarkan radiasi beta (elektron).

Daerah di bawah pita kestabilan adalah daerah dengan harga n/p <
1. Inti-inti yang berada pada daerah ini bersifat tidak stabil karena
kelebihan jumlah proton. Inti-inti jenis ini akan berusaha mencapai
pita kestabilan dengan cara merubah kelebihan proton menjadi netron,
yaitu dengan memancarkan radiasi beta positif (elektron bermuatan
positif) atau dengan cara menangkap elektron dari kulit paling dalam
dengan disertai pemancaran sinar-X. 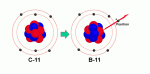

Bagaimana dengan inti-inti yang berada di luar daerah kestabilan
(inti-inti berat, Z>83)? Inti-inti jenis ini akan mencapai pita
kestabilan dengan cara mengurangi bobotnya, yaitu dengan jalan
pemancaran partikel alfa. 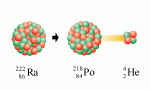
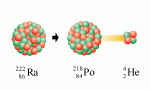
Apabila sekali melepaskan partikel alfa belum cukup, maka akan
dilakukan pemancaran lagi dan lagi sampai diperoleh inti yang stabil.
Serangkaian peluruhan yang terjadi disebut sebagi deret radioaktif atau
derer peluruhan.

Tidak ada komentar:
Posting Komentar